Das Glossar zu LENR

Mizuno, T.: Nuclear Transmutation - Die Realität der kalten Fusion [1998], Infinite Energy Press
sowie Eugene Mallove und Jed Rothwell auf lenr-canr.org
A
Abwärme
Streng genommen, ist es das: „Wärmeenergie, die in einem Energieumwandlungs- oder -transferprozess erzeugt wird, bei der Umwandlung oder Übertragung verloren geht und nicht für nützliche Zwecke verfügbar ist“. Ein typischer Automotor hat beispielsweise einen Wirkungsgrad von 20%, was bedeutet, dass 80% der Wärme des brennenden Benzins über das Abgassystem entweichen und nur 20% in den Fahrzeugantrieb umgewandelt werden. Bei der Stromübertragung enden Umwandlungsverluste und Übertragungs- und Verteilungsverluste als Abwärme. Alle Formen von Energie werden letztendlich zu Wärme abgebaut. Der Fahrzeugantrieb zum Beispiel erwärmt die Luft, die Reifen und die Straße. Allerdings sind die 80% der Abwärme eines Automotors nicht unbedingt komplett im wahrsten Sinne des Wortes verschwendet. Im Winter bewegen Sie einen Hebel zum Öffnen eines Leitblechs und leiten einen Frischluftstrom über den heißen Motorblock in den Fahrgastraum. Mit anderen Worten, Sie nutzen Abwärme, um sich warm zu halten. In einem typischen Kraftwerk werden 66% der Wärme verschwendet. Diese Restwärme ist nicht heiß genug, um mit konventionellen Turbinen Strom zu erzeugen, kann aber für die Raumheizung und andere Zwecke genutzt werden. Siehe Kraft-Wärme-Kopplung.
Alpha-Partikel
Ein von verschiedenen radioaktiven Stoffen beim Zerfall ausgesandtes, positiv geladenes Teilchen. Es besteht aus zwei Neutronen und zwei Protonen, ist also mit dem Kern des Heliumatoms identisch. Die Ruhemasse des Alphateilchens beträgt [math]6,644657 \cdot 10^{–27} kg[/math], das entspricht [math]3,7278 \cdot 10^{9} eV[/math]. Alphastrahlung ist die am wenigsten durchdringende Strahlung der drei Strahlungsarten (Alpha-, Beta-, Gammastrahlung) und wird schon durch ein dickes Blatt Papier absorbiert.
Alpha-Zerfall
Radioaktive Umwandlung, bei der ein Alphateilchen emittiert wird. Beim Alphazerfall nimmt die Ordnungszahl um zwei Einheiten und die Massenzahl um vier Einheiten ab. So entsteht z. B. aus Ra-226 mit der Ordnungszahl [math]88[/math] und der Massenzahl [math]226[/math] durch den Alpha-Zerfall Rn-222 mit der Ordnungszahl [math]86[/math] und der Massenzahl [math]222[/math].
Anode
Die positive Elektrode in einer elektrochemischen Zelle, die Sauerstoff anzieht. Siehe Elektrode / Elektrolyse.
Atom, chemische versus nukleare Reaktionen
Die kleinste Einheit eines Elements, bestehend aus einem positiv geladenen Kern, umgeben von einer Wolke aus negativ geladenen Elektronen. Der größte Teil der Masse eines Atoms konzentriert sich im Kern, der sich aus Protonen und Neutronen zusammensetzt. Chemische Reaktionen betreffen nur die Elektronen und lassen den Kern unverändert. Kernreaktionen beeinflussen den Kern und wandeln das Atom in ein anderes Element oder Isotop um.
Atomkern
Positiv geladener Kern eines Atoms. Sein Durchmesser beträgt einige [math]10^{–13} cm[/math], also rund [math]1 / 100\,000[/math] des Atomdurchmessers. Er enthält fast die gesamte Masse des Atoms. Der Kern eines Atoms ist, mit Ausnahme des Kernes des normalen Wasserstoffes, aus Protonen und Neutronen zusammengesetzt. Die Anzahl der Protonen bestimmt die Kernladungs- oder Ordnungszahl [math]Z[/math], die Anzahl der Protonen plus Neutronen – der Nukleonen – die Nukleonen- oder Massenzahl [math]M[/math] des Kernes.
Atommasse
Die Atommasse ist die Masse eines bestimmten Isotops eines Elements, üblicherweise angegeben in der atomaren Masseeinheit (Einheitszeichen: [math]u[/math]). [math]1 \; u = 1,600\,538\,921 \cdot 10^{–27} kg[/math]. Zu unterscheiden ist dieser Begriff von der relativen Atommasse, früher auch relatives Atomgewicht genannt. Die relative Atommasse ist das Verhältnis der durchschnittlichen Masse des Atoms eines Elements zu einem zwölftel der Masse eines Kohlenstoff-12-Atoms.
B
Beta-Minus-Zerfall
Radioaktive Umwandlung unter Emission eines negativen Elektrons ([math]\beta^–[/math]-Teilchen).
Beta-Partikel
Elektron mit positiver oder negativer Ladung, das von einem Atomkern oder Elementarteilchen beim Beta-Zerfall ausgesandt wird. Entsprechend der Ladung des emittierten Elektrons spricht man auch von Beta-Plus-Strahlung ([math]\beta^+[/math]-Strahlung) und Beta-Minus-Strahlung ([math]\beta^–[/math]-Strahlung).
Beta-Plus-Zerfall
Radioaktive Umwandlung unter Emission eines Positrons ([math]\beta^+[/math]-Partikel).
Beta-Strahlung
Bezeichnet die Emission von Elektronen oder Positronen beim radioaktiven Zerfall. Betastrahlen haben ein Energiekontinuum, angegeben wird jeweils die maximale Energie [math]E_{\beta_{max}}[/math]. Diese beträgt z. B. beim P-32-Zerfall [math]1,7 \, MeV[/math]. Betastrahlen werden bereits durch geringe Schichtdicken (z. B. 2 cm Kunststoff oder 1 cm Aluminium) absorbiert.
Beta-Zerfall
Radioaktive Umwandlung unter Emission eines Beta-Partikels. Beim Beta-Zerfall ist die Massenzahl des Ausgangsnuklids und des neu entstandenen Nuklids gleich, die Ordnungszahl ändert sich um eine Einheit; und zwar wird die Ordnungszahl beim Beta-Zerfall unter Aussendung eines Positrons – Beta-Plus-Zerfall – um eine Einheit kleiner und beim Beta-Zerfall unter Aussendung eines negativen Elektrons – Beta-Minus-Zerfall – um eine Einheit größer.
Bindungsenergie
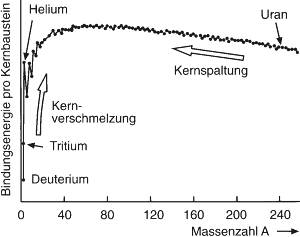
Mit Bindungsenergie wird die erforderliche Energie bezeichnet, um aneinander gebundene Teilchen (unendlich weit) zu trennen. Eine Energie von gleicher Größe wird freigesetzt, wenn sich aus Einzelteilchen ein gebundenes Teilchen bildet. Im Falle eines Atomkernes sind diese Teilchen Protonen und Neutronen, die infolge der Kernbindungsenergie zusammengehalten werden. Neutronen- und Protonenbindungsenergien sind die Energien, die erforderlich sind, um ein Neutron bzw. ein Proton aus einem Kern zu entfernen. Elektronenbindungsenergie ist die Energie, die benötigt wird, um ein Elektron vollständig aus einem Atom oder einem Molekül zu entfernen. Die Bindungsenergie der Nukleonen in einem Atomkern beträgt für die meisten Atomkerne rund [math]8 \, MeV[/math] je Nukleon. Bei den schwersten Atomkernen, wie z. B. Uran, ist die Bindungsenergie je Nukleon deutlich kleiner als bei Atomkernen mit mittleren Massenzahlen. Bei den leichten Atomkernen ist die Bindungsenergie der Atomkerne der Wasserstoffisotope Deuterium und Tritium deutlich geringer als die des Heliumkerns He-4. Die Verschmelzung von Deuterium und Tritium zu Helium ist daher mit einer Energiefreisetzung verbunden.
BTU (British Thermal Unit – Britische Wärmeeinheit)
Die Wärmeenergie, die benötigt wird, um ein Pfund [math](0,45359 \, kg)[/math] Wasser um [math]1 \,^\circ F[/math] zu erhöhen. [math]1 \, Btu = 1055,06 \, Joules \approx 252 \, cal[/math].
C
COP
Der COP steht für Coefficient of Performance und stellt als Leistungszahl das Verhältnis von Nutzleistung zu aufgenommener Leistung dar.
Coulomb-Energie
Größe in der Kernphysik, die von besonderer Bedeutung für den Aufbau der Atomkerne und deren Bindungsenergie ist. Trotz der abstoßenden Coulomb-Kraft zwischen den Protonen werden die leichteren Kerne durch die bedeutend stärkere Kernkraft zusammengehalten. Mit steigender Ordnungszahl [math]Z[/math], d.h. bei schwereren Kernen, ändert sich das jedoch, da die Coulomb-Kraft proportional zu [math]Z^2[/math], die kurzreichweitige Kernkraft dagegen nur proportional zu [math]Z[/math] zunimmt, so dass insgesamt die Abstoßungskräfte im Kern stärker werden. Zwar wird der Effekt der Coulomb-Wechselwirkung durch den Neutronenüberschuss schwerer Kerne abgeschwächt, er lässt sich jedoch nicht beliebig erhöhen, so dass die Kerne letztlich instabil werden.
D
Deuteride
Metall, das Deuterium absorbiert hat. Siehe Hydride.
Deuterium / Tritium
Deuterium ist schwerer Wasserstoff. Gewöhnliche, leichte Wasserstoffatome bestehen aus einem Proton und einem Elektron. Ein schweres Wasserstoffatom hat ein Proton und ein Neutron im Kern und ein Elektron. In gewöhnlicher Luft und Wasser ist etwa ein Wasserstoffatom von 6500 schwerer Wasserstoff. Ein Tritiumatomkern hat ein Proton und zwei Neutronen. Tritium ist ein radioaktives Isotop mit einer Halbwertszeit von 12,3 Jahren. Es gibt praktisch kein messbares Tritium in normaler Luft und Wasser. Deuterium und Tritium sind Isotope von Wasserstoff. Wasser aus Deuterium [math]\left(D_2O\right)[/math] wird als Schweres Wasser bezeichnet. Im Gegensatz dazu wird normales Wasser manchmal als „leichtes Wasser“ bezeichnet, enthält aber tatsächlich einen Teil von 6500 Schweren Wassers. Dieses Verhältnis ist in jedem natürlichen Wasser überall auf der Erde gleich – in Eis, Wasser und Dampf.
Deuteron
Ein Deuterium-Ion; ein Proton und ein Neutron.
E
Elektrolyse / Elektrode / Elektrolyt
Elektrolyse ist die Weitergabe eines elektrischen Stroms von einer Elektrode zur anderen durch eine Flüssigkeit, die als Elektrolyt bezeichnet wird. Die Elektrolyse zerlegt die Flüssigkeitsmoleküle in positiv und negativ geladene Ionen. Die positiv geladenen Ionen werden von der negativen Elektrode (der Kathode) und die negativen Ionen von der positiven Elektrode (der Anode) angezogen. Ein Wassermolekül besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. Wenn es elektrolysiert wird, bricht es auseinander. Die Wasserstoffatome sind positiv geladen, so dass sie von der Kathode angezogen werden, während das freie Sauerstoffatom zur Anode gezogen wird. Um es anders auszudrücken, tritt Oxidation an der Anode und Reduktion an der Kathode auf.
Elektromagnetische Strahlung
Strahlung aus elektrischen und magnetischen Wellen, die sich mit Lichtgeschwindigkeit fortbewegen. Beispiele: Licht, Radiowellen, Röntgenstrahlen, Gammastrahlen. Die elektromagnetische Strahlung pflanzt sich auch im Vakuum fort.
Elektron
Elementarteilchen mit einer negativen elektrischen Elementarladung und einer Ruhemasse von [math]9,109\,383\,56 \cdot 10^{–31} kg[/math] (entspricht einer Ruheenergie von [math]511 \, keV[/math]). Das ist [math]1 / 1836[/math] der Protonenmasse. Elektronen umgeben den positiv geladenen Atomkern und bestimmen das chemische Verhalten des Atoms. Gelegentlich wird das negative Elektron auch als Negatron bezeichnet und der Namen Elektron als Oberbegriff für Negatron und Positron benutzt.
Elektronenvolt (eV, keV, MeV)
Die Energie, die ein Elektron beim Übergang von einem Punkt mit niedrigem Potential zu einem Punkt mit einem um ein Volt höheren Potential gewinnt. Elektronenvolt wird mit [math]eV[/math] abgekürzt; Kilo- und Mega-Elektronenvolt werden mit [math]keV[/math] und [math]MeV[/math] abgekürzt. Chemische Reaktionen erzeugen typischerweise einen Anteil von [math]1 \, eV[/math] pro Atom oder höchstens [math]4[/math] oder [math]5 \, eV[/math]. Kernreaktionen erzeugen MeV-Werte an Energie pro Atom. Ein Elektronenvolt entspricht [math]1,602 \cdot 10^{-19} Joule[/math].
Element
Chemischer Grundstoff, der sich auf chemischem Wege nicht mehr in einfachere Substanzen umwandeln lässt. Beispiele: Sauerstoff, Aluminium, Eisen, Quecksilber, Blei, Uran. Zur Zeit sind 118 chemische Elemente bekannt. Alle Elemente mit der Ordnungszahl 95 und höher sind künstlich hergestellt. Einige Elemente – Technetium, Promethium, Astat, Neptunium und Plutonium – wurden zuerst künstlich hergestellt und erst danach auch ihr natürliches Vorkommen nachgewiesen.
Elementarladung
Kleinste elektrische Ladungseinheit [math](1,6021 \cdot 10^{–19} Coulomb)[/math]. Die elektrische Ladung tritt nur in ganzzahligen Vielfachen dieser Einheit auf. Ein Elektron besitzt eine negative, ein Proton eine positive Elementarladung.
Elementarteilchen
Mit Elementarteilchen bezeichnete man diejenigen Teilchen, die sich nicht ohne weiteres als zusammengesetzt erkennen lassen – etwa im Gegensatz zu den Atomkernen. Innerhalb gewisser Grenzen, die durch die Erhaltungssätze gegeben sind, können sich Elementarteilchen umwandeln. Die Vielzahl solcher „Elementarteilchen“ führte zur „Erfindung“ und schließlich zur Entdeckung der „Quarks“ und in der Folge zum heutigen „Standard-Modell“ elementarer Teilchen. Die fermionischen Teilchen des Standardmodells sind die Teilchen, die als „Materie“ bezeichnet werden, und die bosonischen Teilchen vermitteln nach dem Modell die Wechselwirkungen zwischen den Teilchen, allerdings treten sie auch wie das Photon als eigenständiges Teilchen auf. Die Fermionen des Standard-Modell bestehen aus zwölf Teilchen und ebenso vielen Antiteilchen. So besteht das Proton aus zwei „Up-Quarks“ und einem „Down-Quark“, das Neutron aus einem „Up“ und zwei „Downs“, wobei zur Erfüllung der elektrischen Ladungsbedingungen das Up-Quark eine Ladung von [math]+\frac23[/math] und das Down-Quark von [math]-\frac13[/math] elektrischen Elementarladungen hat.
Energie versus Leistung
Energie ist Wärme oder die Fähigkeit, Arbeit zu verrichten. Kraft ist das momentane Maß für die Energie. Zum Beispiel kann die Leistung in einem bestimmten Moment 10 Watt betragen. Wenn diese Kraft 20 Sekunden lang konstant bleibt, summiert sie sich auf bis zu 200 Joule. Die Leistung ist analog zur Geschwindigkeit, und die Energie ist analog zur gesamten zurückgelegten Strecke. [math](Geschwindigkeit \cdot Dauer = Entfernung;[/math] [math]Leistung \cdot Dauer = Energie)[/math] Große Energiemengen werden manchmal in Kilowattstunden gemessen. Eine Kilowattstunde sind [math]1000 \, Watt[/math], die für [math]1 \, Stunde[/math] fortgesetzt werden, oder [math]3,6 \, Millionen \, Joule[/math].
Energieeinheiten
Die Einheit der Energie ist das [math]Joule[/math], Kurzzeichen: [math]J[/math]. Die früher gebräuchliche Einheit [math]Kilokalorie \, (kcal)[/math] wurde bei der Übernahme des internationalen Einheitensystems in Deutschland ab 01.01.1978 durch die Einheit [math]Joule[/math] ersetzt. Im Bereich der Kernphysik werden Energiewerte überwiegend in [math]Elektronvolt \, (eV)[/math] angegeben. [math]1 \, eV = 1,602 \cdot 10^{–19} J[/math]. Weithin verbreitet ist die Angabe von Energiewerten in [math]Kilowattstunden \, (kWh)[/math]. [math]1 \, kWh = 3,6 \cdot 10^{6} J[/math]. Orientiert am Energieinhalt der Kohle, ist in der Energieversorgung auch die Steinkohleneinheit [math](SKE)[/math] gebräuchlich: [math]1 \; Tonne SKE[/math] entspricht einer Tonne Steinkohle mit einem Heizwert von [math]29,3 \; Milliarden \; Joule = 7 \; Millionen \; kcal[/math].
Exothermisch / endothermisch
Eine exotherme chemische oder nukleare Reaktion erzeugt Wärme. Eine endotherme Reaktion absorbiert Wärme. Eine endotherme Reaktion findet in einer Kaltfusionszelle statt, wenn das Palladium zunächst viel Wasserstoff oder Deuterium unter Bildung eines Hydrids absorbiert. Diese absorbiert Wärme und kühlt die Umgebung. Nach dem Abschalten des Stroms entweicht ein Großteil des Wasserstoffs allmählich aus der Kathode, was eine exotherme Reaktion ist. Die beiden heben sich gegenseitig auf; die von der ersten Reaktion aufgenommene Wärme entspricht der von der zweiten erzeugten Wärme, wenn der gesamte Wasserstoff das Palladium verlässt. (Eigentlich bleibt normalerweise ein Großteil des Wasserstoffs zurück; es ist schwierig, alles herauszufahren.) Die Kalte Fusion hat weitaus mehr Wärme produziert als diese chemischen Reaktionen. In einigen Fällen hat es Tausende mal mehr produziert, und in einigen wenigen Fällen hat es Hunderttausende mal mehr produziert.
F
Fusion
Bildung eines schwereren Kernes aus leichteren Kernen; dabei wird Energie, die Bindungsenergie, frei. Mögliche Fusionsreaktionen:
[math]D + T \to \, ^4He + n + 17,58 \, MeV[/math],
[math]D + D \to \, ^3He + n + 3,27 \, MeV[/math],
[math]D + D \to T + p + 4,03 \, MeV[/math],
[math]D + \, ^3He \to \, ^4He + p + 18,35 \, MeV[/math],
[math]p \, + \, ^{11}B \to \, 3 \, ^4He + 8,7 \, MeV[/math].
Die Deuterium-Tritium-Reaktion ist unter allen möglichen Fusionsreaktionen noch am leichtesten zu verwirklichen.
Fusion / Spaltung
Die Spaltung bricht die Atomkerne schwerer Elemente auseinander, um leichtere Elemente zu bilden. Fusion bedeutet, schwerere Elemente aufzubauen, indem man leichtere Elemente miteinander kombiniert. Elemente, die schwerer sind als Eisen, geben bei der Spaltung Energie ab. Spaltelemente, die leichter als Eisen sind, verbrauchen mehr Energie, als sie freisetzen. Die Fusion ist das Gegenteil: Je leichter das Element, desto mehr Energie entsteht während der Fusion. Die Fusion des leichtesten Elements, des Wasserstoffs, erzeugt die meiste Energie aller atomaren Prozesse. Diese Energie treibt die Sterne an. Sowohl die Spaltung als auch die Fusion führen zur Transmutation: Sie verändern ein Element oder Isotop in ein anderes.
G
Gamma-Strahlung
Hochenergetische, kurzwellige elektromagnetische Strahlung, die von einem Atomkern ausgestrahlt wird. Die Energien von Gamma-Strahlen liegen gewöhnlich zwischen [math]10 \, keV[/math] und [math]10 \, MeV[/math]. Auch Röntgenstrahlen treten in diesem Energiebereich auf; sie haben aber ihren Ursprung nicht im Atomkern, sondern sie entstehen durch Elektronenübergänge in der Elektronenhülle oder durch Elektronenbremsung in Materie (Bremsstrahlung). Im Allgemeinen sind Alpha- und Beta-Zerfälle und immer der Spaltungsvorgang von Gamma-Strahlung begleitet. Gamma-Strahlen sind sehr durchdringend und lassen sich am besten durch Materialien hoher Dichte (Blei) und hoher Ordnungszahl schwächen.
H
Helium
Das zweitleichteste Element mit zwei Isotopen: Helium-3, mit zwei Protonen und einem Neutron, das instabil ist, und Helium-4 mit zwei Protonen und zwei Neutronen, das stabil ist. Helium-4 ist das Nebenprodukt vieler Kernreaktionen. Es gibt gute Beweise dafür, dass die Kaltfusionsreaktion sie hervorruft.
Hitze nach dem Tod - Heat after death
In einigen Experimenten der Kalten Fusion ist die Palladiumkathode lange Zeit heiß geblieben, nachdem die Elektrolyse abgeschaltet wurde und die Zelle abgekühlt sein sollte. Fleischmann und Pons berichteten das zuerst und nannten es „Hitze nach dem Tod“ (Heat after death).
Hydrid
Ein Metall, das Wasserstoff absorbiert hat, wie Kaffee Zucker absorbiert. Ein Deuterid ist ein Metall, das Deuterium absorbiert hat. Generell bedeutet dies eine Verbindung von Wasserstoff mit einem elektro-positiven Element oder einer Gruppe.
Hyperonen
Gruppe kurzlebiger Elementarteilchen, deren Masse größer ist als die des Neutrons.
I
Ion
Ein elektrisch geladenes Atom oder eine Gruppe von Atomen. Ein positives Ion ist ein Atom, das von einem oder mehreren äußeren Elektronen befreit wurde. Ein negatives Ion hat zusätzliche Elektronen.
Isotone
Atomkerne mit gleicher Neutronenzahl. Beispiel: S-36, Cl-37, Ar-38, K-39, Ca-40. Diese Kerne enthalten jeweils 20 Neutronen, aber eine unterschiedliche Anzahl von Protonen: Schwefel 16, Chlor 17, Argon 18, Kalium 19 und Kalzium 20 Protonen.
Isotope / Isotopenverhältnis
Atome mit der gleichen Anzahl von Protonen, aber einer unterschiedlichen Anzahl von Neutronen. Ein Element kann mehrere Isotope aufweisen. Zum Beispiel haben Kupferatome immer 29 Protonen, aber einige haben 34 Neutronen und andere 36, was einige Kupferatome schwerer macht als andere. Die beiden Isotope aus Kupfer haben eine Atommasse von [math]63 \; (29 + 34)[/math] und [math]65 \; (29 + 36)[/math]. Diese Isotope werden als Kupfer-63 [math](^{63}Cu)[/math] und Kupfer-65 [math](^{65}Cu)[/math] bezeichnet. Einige Elemente, wie Gold, haben nur ein Isotop. Die meisten Isotope haben grob die gleichen chemischen Eigenschaften, aber es wurden subtile Unterschiede im Verhalten beobachtet, wie zum Beispiel eine bessere Leitfähigkeit mit verschiedenen Isotopen von Eisen. Es mag noch viel mehr unentdeckte Unterschiede zwischen den Isotopen geben, aber dieses Thema wurde nicht im Detail untersucht, da es schwierig und teuer ist, Isotope zu trennen und reine monoisotope Proben herzustellen.
Verschiedene Isotope eines Elements befinden sich in unterschiedlichen Verhältnissen, und diese Verhältnisse sind fix. Zum Beispiel sind [math]69\%[/math] von Kupfer Kupfer-63, [math]31\%[/math] sind Kupfer-65. Bei anderen Elementen sind die Isotopenverhältnisse extremer: [math]99,762\%[/math] des gesamten Sauerstoffs sind Sauerstoff-16; Sauerstoff-17 liegt bei [math]0,038\%[/math] und Sauerstoff-18 bei [math]0,200\%[/math]. Wenn ein Element mit unnatürlichen Isotopenverhältnissen (auch als unnatürliche Isotopenverteilung bezeichnet) gefunden wird, kann dies nur zwei Quellen haben:
- Es kann von Menschenhand unter Verwendung einer chemischen oder physikalischen Trenntechnik hergestellt worden sein. Ontario Hydro produziert gereinigtes Schwerwasser für CANDU-Spaltreaktoren. Uranisotope werden getrennt, um Atombomben herzustellen.
- Es kann von einer Kernreaktion stammen, bei der ein Element in ein oder mehrere andere Elemente umgewandelt wird. Die Kalte Fusion kann das Isotopenverhältnis verändern, was beweist, dass es sich um eine Kernreaktion handelt.
J
Joule
Ein Maß für Energie; ein Watt Leistung, das für eine Sekunde erhalten bleibt. [math]1 \, Kalorie = 4,2 \, Joule[/math].
K
Kalibrieren
In der ersten Phase eines Experiments wird ein Instrument kalibriert, indem eine bekannte Größe gemessen oder mit einem Standardinstrument höherer Qualität verglichen wird. So kann beispielsweise ein Thermometer kalibriert werden, indem es in Eisschlamm getaucht wird, der bei 0°C (per Definition) und kochendem Wasser bei 100°C liegt. Oder man stellt ihm einen Becher mit warmem, gerührtem Wasser zusammen mit zwei weiteren hochwertigen Thermometern zur Verfügung. Wenn das Wasser abkühlt, werden die auf allen drei Thermometern angezeigten Temperaturen notiert und ein Korrekturfaktor für das Zielthermometer bestimmt. Ein Kalorimeter kann kalibriert werden, indem man einen elektrischen Heizer in den Probenraum stellt und für mehrere Stunden 1 Watt durch den Heizer läuft, dann 2 Watt, 3, 4 und 5 Watt. Bei jeder Leistungsstufe stabilisiert sich das Kalorimeter bei einer bestimmten Temperatur, wenn die ins Wasser eintretende Wärme durch Verluste aus den Kalorimeterwänden an die Umgebung ausgeglichen wird. Angenommen, Sie stellen fest, dass sich die Temperatur bei 1 Watt 2,4°C über der Umgebungstemperatur, bei 2 Watt 4,8, bei 3 Watt 7,2 und so weiter absetzt. Sie grafisieren diese Temperaturen, um eine Kalibrierkurve zu erstellen, und Sie bestimmen, dass die Kalibrierkonstante 2,4°C pro Watt oder 0,42 Watt pro Grad Celsius beträgt. Später erhöht eine im Kalorimeter platzierte Probe die Temperatur um 5,1°C. Sie wissen, dass die Probe 2,1 Watt Wärme erzeugt. Diese Methode der Kalibrierung funktioniert, weil die vom Heizgerät in der Kammer verbrauchte elektrische Leistung mit großer Genauigkeit gemessen werden kann und die Leistung über die Zeit stabil bleibt. Die Kalibrierung ist mit qualitativ schlechten Messgeräten und einer minderwertigen Stromversorgung, die schwankende Leistung erzeugt, weniger zuverlässig. Die größte Schwierigkeit bei der Kalibrierung eines Kalorimeters ist oft das Rauschen, das durch Temperaturänderungen in der Umgebung verursacht wird. Bei einem Experiment zur Kalten Fusion können die Kalibrierung und eine weitere Prüfung der Instrumente Monate dauern.
Kalorie
Die Energie, die benötigt wird, um ein Gramm Wasser um ein Grad Celsius zu erhöhen. Dies entspricht etwa [math]4,19 \, Joule[/math] (Watt-Sekunden). Beachten Sie, dass eine „diätetische“ oder „große Kalorie“ 1000 Kalorien (1 Kilokalorie) entspricht. Der Energiegehalt der Nahrung, wenn sie im Körper oxidiert wird, wird in großen Kalorien gemessen.
Kalorimeter
Ein Instrument, das die durch einen exothermen Prozess erzeugte Wärme oder die durch einen endothermen Prozess aufgenommene Wärme misst. Herkömmliche, altmodische Kalorimeter umgeben die Probe mit Wasser. Die Probe erwärmt sich (oder kühlt ab) und die Wassertemperatur steigt (oder fällt). Die Wassermasse und die Temperatur geben an, wie viel Wärmeenergie erzeugt wurde. In einem modernen elektronischen Seebeck Kuvertkalorimeter wird die Probe von Panels umgeben, die Hunderte von Thermoelementen enthalten, die in Reihe geschaltet sind – eine Thermosäule. Die Nettoleistung aller Thermoelemente zusammen zeigt die Wärmemenge an, die aus der Probe entweicht.
Katalysator
Eine Substanz, die die Geschwindigkeit einer Reaktion modifiziert und in der Regel erhöht, ohne dabei verbraucht zu werden. In einer geschlossenen Kaltfusionszelle werden oft Platinnetze oder -perlen als Katalysator verwendet, der das freie Deuteriumgas dazu bringt, sich bei niedrigen Temperaturen mit Sauerstoff zu rekombinieren.
Kathode
Die negative Elektrode in einer elektrochemischen Zelle, die Wasserstoff anzieht. (Siehe Elektrode / Elektrolyse.) In einem konventionellen Kaltfusionsexperiment besteht die Kathode aus Palladium, das den Wasserstoff absorbiert.
Kernenergie
Innere Bindungsenergie der Atomkerne. Die Kernbausteine sind von einer Atomsorte zur anderen verschieden stark aneinander gebunden. Das Maximum der Bindungsenergie je Kernbaustein liegt im Bereich der Massezahl 60. Durch Kernumwandlungen kann deshalb Energie bisher entweder durch Spaltung (Fission) schwerer Kerne wie Uran oder durch Verschmelzung (Fusion) leichter Kerne wie Wasserstoff gewonnen werden. Die Spaltung von 1 kg U-235 liefert rund [math]23 \, Mio. \, kWh[/math], bei der Fusion von Deuterium und Tritium (DT-Reaktion) zu 1 kg Helium wird eine Energie von rund [math]120 \, Mio. \, kWh[/math] frei. Die Verbrennung von 1 kg Steinkohle liefert dagegen nur etwa [math]10 \, kWh[/math].
Kernspaltung
Spaltung eines Atomkernes in zwei Teile etwa derselben Größe durch den Stoß eines Teilchens. Die Kernspaltung kann bei sehr schweren Kernen auch spontan auftreten. Bei der Kernspaltung von Uran-235 wird durch Einfang eines Neutrons der Urankern zur Spaltung angeregt. Dabei entstehen im Allgemeinen zwei – seltener drei – Spaltprodukte, zwei bis drei Neutronen und Energie. Im Urankern sind die Nukleonen mit einer mittleren Energie von etwa [math]7,6 \, MeV[/math] pro Nukleon gebunden. In den Spaltproduktkernen beträgt die mittlere Bindungsenergie je Nukleon etwa [math]8,5 \, MeV[/math]. Diese Differenz in der Bindungsenergie von [math]0,9 \, MeV[/math] je Nukleon wird bei der Kernspaltung freigesetzt. Da der Urankern 235 Nukleonen besitzt, wird pro Spaltung ein Energiebetrag von rund [math]210 \, MeV[/math] frei.
Kilowatt (kW)
Ein Maß für die Leistung: [math]1000 \, Watt[/math].
Kilowattstunde (kWh)
Ein Maß für die Energie: 1000 Watt Leistung, die eine Stunde lang aufrechterhalten werden. [math]1 \, Kilowattstunde = 3,6 \, Millionen \, Joule \, (Megajoule)[/math]
Kraft-Wärme-Kopplung (KWK)
Die meisten herkömmlichen Stromerzeuger verschwenden zwei Drittel der von ihnen verbrauchten Energie und erzeugen große, aufblähende Dampfwolken aus Kühltürmen. Der Dampf ist nicht heiß genug, um eine Turbine zu betreiben, aber er ist heiß genug für viele industrielle Anwendungen oder zur Raumheizung. Bei der Kraft-Wärme-Kopplung wird der Dampf in Fabriken oder Gebäude geleitet, in denen er eingesetzt wird.
L
Leistung
Siehe Energie versus Leistung
M
Massendefekt
Massendefekt bezeichnet die Tatsache, dass die aus Protonen und Neutronen aufgebauten Atomkerne eine kleinere Ruhemasse haben als die Summe der Ruhemassen der Protonen und Neutronen, die den Atomkern bilden. Die Massendifferenz entspricht der freigewordenen Bindungsenergie. Beispiel: Die Masse eines Protons beträgt [math]1,672\,622 \cdot 10^{–27} \, kg[/math], die eines Neutrons [math]1,674\,927 \cdot 10^{–27} \, kg[/math]. Zwei Protonen plus zwei Neutronen haben also als einzelne Teilchen eine Masse von [math]6,695\,098 \cdot 10^{–27} \, kg[/math]. Das aus zwei Protonen und zwei Neutronen zusammengesetzte Alphateilchen – der Kern eines Heliumatoms – hat eine Masse von [math]6,644\,656\,23 \cdot 10^{–27} \, kg[/math]. Das Zusammenführen der zwei Protonen und zwei Neutronen zu einem Heliumkern ergibt also einen Massendefekt von [math]0,050\,442 \cdot 10^{–27} \, kg[/math]. Das entspricht einer Energie von etwa [math]28 \, MeV[/math], die als Bindungsenergie freigesetzt wird.
Massenzahl
Masse eines Atoms in Kernmasseneinheiten.
Molekül
Eine durch chemische Kräfte zusammengehaltene Atomgruppe. Die Atome des Moleküls können identisch [math]\left( H_2, \; N_2, \; S_2 \right)[/math] oder verschieden sein [math]\left(H_2O, \; CO_2 \right)[/math].
N
Neutrino
Gruppe elektrisch neutraler Elementarteilchen mit einer Masse, die nahezu Null ist.
Neutron
Ein neutrales (ungeladenes) Teilchen im Kern aller Atome außer leichtem Wasserstoff mit einer Masse von [math]1,674\,927\,471 \cdot 10^{–27} \, kg[/math]. Ein Neutron hat damit eine geringfügig größere Masse als das Proton. Das freie Neutron ist instabil und zerfällt mit einer Halbwertszeit von [math]10,15 \, Minuten[/math].
Neutron, langsames
Neutron, dessen kinetische Energie einen bestimmten Wert – häufig werden [math]10 \, eV[/math] gewählt – unterschreitet.
Neutron, mittelschnelles
Neutron mit einer Energie, die größer als die eines langsamen Neutrons, jedoch kleiner als die eines schnellen Neutrons ist; im Allgemeinen der Bereich zwischen [math]10[/math] und [math]100\,000 \, eV[/math].
Neutron, schnelles
Neutron mit einer kinetischen Energie von mehr als [math]0,1 \, MeV[/math].
Neutronen, epithermische
Neutronen, deren kinetische Energieverteilung die der thermischen Bewegung überschreitet.
Neutronen, thermische
Neutronen im thermischen Gleichgewicht mit dem umgebenden Medium. Thermische Neutronen haben bei [math]293,6 \, ^\circ K[/math] eine wahrscheinlichste Neutronengeschwindigkeit von [math]2200 \, m/s[/math], das entspricht einer Energie von [math]0,0253 \, eV[/math].
Nukleon
Gemeinsame Bezeichnung für Proton und Neutron.
Nukleonenzahl
Anzahl der Protonen und Neutronen – der Nukleonen – in einem Atomkern.
Nuklid
Ein Nuklid ist eine durch seine Protonenzahl, Neutronenzahl und seinen Energiezustand charakterisierte Atomart. Zustände mit einer Lebensdauer von weniger als [math]10^{–10} \, s[/math] werden angeregte Zustände eines Nuklids genannt. Zur Zeit sind rund 4000 verschiedene Nuklide und isomere Zustände bekannt, die sich auf die 118 zur Zeit bekannten Elemente verteilen. Davon sind über 3700 Nuklide radioaktiv.
O
Ordnungszahl
Anzahl der Protonen in einem Atomkern. Jedes chemische Element ist durch seine Ordnungszahl bestimmt. Die Anordnung der Elemente nach steigender Ordnungszahl ist die Grundlage des Periodensystems der Elemente.
P
Paarbildung
Wechselwirkung von energiereicher elektromagnetischer Strahlung mit Materie. Ist die Energie der Strahlung größer als [math]1,02 \, MeV[/math] und damit größer als die doppelte Ruhemasse eines Elektrons [math]\left( m_{e,0} = \, 0,511 \, MeV \right)[/math], besteht die Möglichkeit zur Erzeugung eines EIektron-Positron-Paares (Materialisation von Energie).
Palladium / Platin / Platingruppenmetalle (PGM)
Diese Edelmetalle haben ähnliche Eigenschaften, und die Erze kommen oft zusammen vor. Palladium absorbiert eine große Menge an Wasserstoff und wird daher in Wasserstofffiltern, Hydrierkatalysatoren und Kaltfusionskathoden eingesetzt. Platin wird häufig für die Anode in einer Kaltfusionszelle oder als Kathode in einem Kontrolllauf verwendet, d.h. in einem Test, der keine überschüssige Wärme erzeugen soll, zur Kalibrierung der Geräte zur Vorbereitung auf einen Test mit Palladium. Zu den Platingruppenmetallen gehören Iridium, Osmium, Palladium, Platin, Rhodium und Ruthenium.
Periodensystem
Ordnungssystem der Elemente nach steigender Ordnungszahl. Einteilung entsprechend der Elektronenkonfiguration der Atomhülle in „Perioden“. Durch das gewählte Ordnungsschema stehen chemisch ähnliche Elemente in „Gruppen“ (Haupt- und Nebengruppen) untereinander.
Photon
Energiequant der elektromagnetischen Strahlung. Die Ruhemasse des Photons ist Null. Es hat keine elektrische Ladung.
Plasma
Atome, die in Protonen, geladene Atome, Neutronen und Elektronen in einem hochionisierten gasähnlichen Zustand zerfallen. Plasma ist elektrisch neutral.
Positron
Elementarteilchen mit der Masse eines Elektrons, jedoch positiver Ladung. Es ist das „Anti-Elektron“. Es wird beim Beta-Plus-Zerfall ausgesandt und entsteht bei der Paarbildung.
Protium
Ein Isotop des Wasserstoffs, das aus einem Proton und einem Elektron besteht. Neben Deuterium ([math]^2H[/math] oder [math]D[/math]) mit [math]0,0145\%[/math] und Tritium ([math]^3H[/math] oder [math]T[/math]) mit [math]10^{-15} \%[/math] hat Protium ([math]^1 H[/math]) mit [math]99,985\%[/math] den größten Anteil. In Verbindung mit Sauerstoff bildet es Wasser [math]H_2O[/math].
Proton
Elementarteilchen mit einer positiven elektrischen Elementarladung und einer Masse von [math]1,672\,621\,777 \cdot 10^{–27} \, kg[/math], das entspricht rund dem 1836-fachen der Elektronenmasse. Protonen und Neutronen bilden zusammen den Atomkern. Die Zahl der Protonen im Atomkern bestimmt das chemische Element, dem dieses Atom zugeordnet ist.
R
Radioaktive Abfälle
Abfälle aus dem Uranbergbau, der Kernenergieerzeugung oder der Kernwaffenproduktion. Die Entsorgung von Altgeräten ist ein großes Problem.
Radioaktiver Zerfall
Beim radioaktiven Zerfall wird ein Partikel aus dem Kern eines Atoms emittiert, und das Atom wandelt sich von einem Element in ein anderes. Es gibt drei Formen des natürlichen Zerfalls (spontaner Zerfall), bei denen sich Atome ohne äußeren Einfluss verwandeln. Ein Alpha-Partikel wird von einer Form des natürlichen radioaktiven Zerfalls emittiert. Beim Alpha-Partikel handelt es sich um einen Heliumkern: zwei Protonen und zwei Neutronen. Alpha-Partikel sind positiv geladen. Der Alpha-Zerfall tritt bei schwereren Elementen auf, die über der Mitte des Periodensystems liegen. Zwei weitere Formen des radioaktiven Zerfalls treten bei Uran und schwereren Elementen auf: spontane Spaltung und Beta-Zerfall. Spontane Spaltung tritt auf, wenn sich ein schweres Element in zwei nahezu gleiche Fragmente aufspaltet und zwei Atome leichterer Elemente bildet. Der Beta-Zerfall beinhaltet Elektronen, die von einem Kern emittiert oder von ihm eingefangen werden. Da Elektronen viel leichter sind als Protonen und Neutronen, ändert sich die Masse des Atoms nur wenig, die Massenzahl bleibt gleich, aber das Element wird in ein anderes Element umgewandelt. So besteht beispielsweise Tritium (superschwerer Wasserstoff) aus einem Proton und zwei Neutronen, Massenzahl 3. Wenn Tritium dem Beta-Zerfall unterliegt, wandelt sich ein Neutron in ein Proton um, ein Elektron wird emittiert, und das Atom verwandelt sich von Wasserstoff in Helium-3 (zwei Protonen, ein Neutron), immer noch mit der Massenzahl 3. Es gibt drei Arten des Beta-Zerfalls:
- Negativer Elektronen-Beta-Zerfall, bei dem ein Neutron in ein Proton umgewandelt wird, ein Elektron emittiert wird und das Element in das nächsthöhere Element übergeht.
- Positronenemission, bei der ein Proton in ein Neutron übergeht und ein positives Elektron (ein Positron) emittiert wird und das Element zum nächst niedrigeren Element übergeht.
- Elektroneneinfang, auch K-Erfassung genannt. Ein Elektron aus der untersten Umlaufbahn (der K-Shell-Umlaufbahn) wird von einem Proton eingefangen, das sich in ein Neutron verwandelt, und das Element wandelt sich in das nächst niedrigere Element. Dies sind natürliche Formen des radioaktiven Zerfalls, d.h. die Atome verändern sich von selbst, im Gegensatz zu nuklearen Veränderungen, die auftreten, wenn eine Menge an Material in einem Reaktor oder einer Atombombe gesammelt wird oder wenn Neutronen aus einem Reaktor ein Material bombardieren. In diesem Fall verursachen Neutronen aus einer Reaktion eine andere Reaktion in einem anderen Atom.
Ruheenergie
Aus der Relativitätstheorie folgt, dass zwischen Masse und Energie eine Äquivalenzbeziehung besteht. Die Energie ist gleich dem Produkt aus Masse und dem Quadrat der Lichtgeschwindigkeit: [math]E = m \cdot c^2[/math]. Die Ruheenergie [math]E_0[/math] ist also das Energieäquivalent eines ruhenden, d. h. nicht bewegten Teilchens. So beträgt z. B. die Ruheenergie des Protons [math]938,257 \, MeV[/math]. Die Ruheenergie von [math]1 \, g[/math] Masse entspricht etwa [math]2,5 \cdot 10^7 \, kWh[/math].
Ruhemasse
Die Masse eines Teilchens, das sich in Ruhe befindet. Nach der Relativitätstheorie ist die Masse geschwindigkeitsabhängig und nimmt mit wachsender Teilchengeschwindigkeit zu. Ist [math]m_0[/math] die Ruhemasse, [math]v[/math] die Teilchengeschwindigkeit und [math]c[/math] die Lichtgeschwindigkeit, so errechnet sich die geschwindigkeitsabhängige Masse [math]m[/math] aus:
S
Schweres Wasser / leichtes Wasser
Deuteriumoxid, [math]D_2O[/math] – Wasser, das an Stelle der zwei leichten Wasserstoffatome zwei Deuteriumatome enthält. Natürliches Wasser enthält ein Deuteriumatom pro 6500 Molekülen [math]H_2O[/math].
Steinkohleneinheit (SKE)
Bezugseinheit für die energetische Bewertung verschiedener Energieträger. [math]1 \, kg[/math] Steinkohleneinheit (kg SKE) entspricht einem mit 7000 Kilokalorien [math](7000 \, kcal \approx 29,3 \, MJ \approx 8,141 \, kWh)[/math] festgelegten Wert und damit etwa dem Heizwert der Steinkohle, der je nach Sorte [math]29,3[/math] bis [math]33,5 \, MJ/kg[/math] beträgt.
Stromstärke, Spannung
Siehe Volt.
T
Thermoelektrischer Chip
Ein thermoelektrischer Chip wandelt Wärme in Strom um, ohne bewegliche Teile, ähnlich wie ein Photovoltaik-Chip auf einem Taschenrechner Licht in Strom umwandelt. Thermoelektrische Geräte sind reversible Wärmepumpen. Wenn Sie ein thermoelektrisches Gerät Wärme aussetzen, erzeugt es Strom (Seebeck-Effekt), und wenn Sie elektrischen Strom durch ein thermoelektrisches Gerät leiten, zieht es Wärme von einer Seite zur anderen und wirkt als Wärmepumpe oder Kühlschrank (Peltiereffekt). Heutige thermoelektrische Chips sind ineffizient, so dass sie nur selten zur Stromerzeugung eingesetzt werden. Sie werden hauptsächlich bei Kühlschränken eingesetzt. Dies sind typischerweise große Boxen zur Bierkühlung, die von der automatischen Zigarettenanzünder-Verbindung angetrieben werden. Wenn Sie Strom durch sie leiten, wird eine Seite des Chips heiß und die andere kalt. Eigentlich arbeiten sie entweder als Kühlschränke oder als Heizgeräte. Drücken Sie den Netzschalter in eine Richtung, bleibt der Inhalt des Bierkühlers kalt. Drücken Sie den Netzschalter in die andere Richtung, kehren Sie den Strom um, wird das Innere der Box warm, weil von außen Wärme in die Box gepumpt wird.
Transmutation
Die Umwandlung eines Elements in ein anderes durch Spaltung (Zerlegung der Atomkerne) oder Fusion (Zusammenführung und Kombination der Kerne).
Tritium
Radioaktives Isotop des Wasserstoffs mit zwei Neutronen und einem Proton im Kern. Tritium wird z. B. zur Herstellung von Leuchtfarben, als Indikator in Tracer-Versuchen und als Brennstoff in kontrollierten Fusionsversuchen verwendet. Tritium ist ein Beta-Strahler mit einer Maximalenergie von [math]18 \, keV[/math] und mit einer Halbwertszeit von [math]12,323 \, Jahren[/math].
Triton
Atomkern des Tritiums. Er besteht aus einem Proton und zwei Neutronen.
U
Überschüssige Wärme
Wärme, die durch eine chemische oder nukleare Reaktion innerhalb eines Kalorimeters über die Wärmezufuhr von externen Quellen in die Zelle hinaus erzeugt wird. In einem Kaltfusionsexperiment, bei dem die Elektrolyse 4 Watt verbraucht, die Zelle aber 5 Watt erzeugt, ist das zusätzliche 1 Watt überschüssige Wärme. Man kann zunächst nicht sagen, ob sie durch eine chemische oder nukleare Reaktion verursacht wird. Wenn es lange Zeit so weitergeht, dass sich viel mehr Energie addiert, als die chemische Reaktion erzeugen könnte, und wenn Sie nach Beendigung des Experiments keinen Hinweis auf eine chemische Reaktion finden, wissen Sie, dass sie stattdessen durch eine Kernreaktion verursacht worden sein muss.
V
Volt
Die Spannung ist ein Maß für das elektrische Potential oder die elektromotorische Kraft. Die elektrische Gleichstromleistung wird in Volt multipliziert mit Ampere gemessen. Eine Erhöhung der beiden wird den Arbeitsaufwand erhöhen, den der Strom leisten kann. In einer groben Analogie zu einem Fluss, der ein Wasserrad antreibt, um Arbeiten auszuführen, ist die Spannung die Höhe, die das Wasser fällt, und die Stromstärke ist das Volumen des Wassers.
W
Watt (elektrisch, thermisch)
Ein Maß für die Energie. Bei Gleichstrom [math]Watt = Volt \cdot Ampere[/math]. Ein thermisches Watt ist die Wärmemenge, die von einer Heizung erzeugt wird, die ein Watt elektrische Leistung verbraucht.
Wechselwirkung
Einfluss eines physikalischen Körpers auf einen anderen Körper oder auch die Kopplung zwischen einem Feld und seiner Quelle. Es gibt Wechselwirkungen verschiedenster Art, z. B. Gravitationswechselwirkung, elektromagnetische Wechselwirkung, schwache Wechselwirkung, starke Wechselwirkung.xyz
Wechselwirkung, schwache
Wechselwirkung zwischen Elementarteilchen, bei der die Parität nicht erhalten bleibt, z. B. Beta-Zerfall.
Wechselwirkung, starke
Die starke Wechselwirkung bewirkt den Zusammenhalt der Nukleonen im Atomkern. Sie ist neben der elektromagnetischen und der schwachen Wechselwirkung die dritte bekannte Wechselwirkung zwischen den Elementarteilchen. Die starke Wechselwirkung verhält sich zur elektromagnetischen, zur schwachen und zur Gravitationswechselwirkung wie [math]1 \; : \; 10^{-3} \; : \; 10^{-15} \; : \; 10^{-40}[/math].
Wirkungsquerschnitt
Maß für die Wahrscheinlichkeit des Auftretens einer Reaktion. Der Wirkungsquerschnitt stellt die scheinbare Fläche dar, die ein Zielkern einem ankommenden Teilchen bietet. Der Wirkungsquerschnitt wird in Flächeneinheiten angegeben. Häufig werden Neutronen-Wirkungsquerschnitte in der Einheit [math]Barn[/math] – Einheitenkurzzeichen: [math]b[/math] – angegeben. [math]1 \, b[/math] ist gleich [math]10^{-28} \, m^2[/math].